首页 > 病种新闻 > 肿瘤科 > 肿瘤科 > PD-1遏制剂百泽安——经典型霍奇金淋巴瘤显著获益
PD-1遏制剂百泽安——经典型霍奇金淋巴瘤显著获益
在淋巴瘤治疗领域中,第一个免疫检查点遏制剂在2014年获批应用,2018年正式进入国内市场。随着PD-1遏制剂的问世,免疫治疗成为很多患者...
摘要:
在淋巴瘤治疗领域中,第一个免疫检查点遏制剂在2014年获批应用,2018年正式进入国内市场。随着PD-1遏制剂的问世,免疫治疗成为很多患者的新希望。2019年12月,国家药品监督管理局(NMPA)批准PD-1遏制剂替雷利珠单抗用于至少经过二线系统化疗复发/难治性经典型霍奇金淋巴瘤(r/r cHL)的治疗,自此,国内本土创新PD-1遏制剂百泽安(通用名:替雷利珠单抗注射液)正式登入免疫治疗的舞台。这是百泽安第一个获批的适应证,这项适应证的获批得益于BGB-A317-203(以下简称203研究)这一国内关键性研究(NCT03209973)数据,该研究结果于2019年9月在血液病学优秀期刊《白血病》(Leukemia)杂志公开发表。作为国内本土创新药物之光,PD-1遏制剂百泽安有哪些卓越疗效?与其他PD-1遏制剂相比好在哪里?来随小编一探究竟。
PD-1遏制剂百泽安——203研究
研究背景
我国经典型霍奇金淋巴瘤(cHL)发病率约占淋巴瘤的8%左右,占全部霍奇金淋巴瘤(HL)的95%。尽管标准一线治疗方案已极大地改善了cHL患者的生存,但r/r cHL的治疗需求仍未满足,自体造血**移植(ASCT)治疗r/r cHL应用中存在诸多困难,移植后易复发。
CHL的肿瘤细胞RS细胞通常表现出染色体9p24.1的扩增,从而导致肿瘤细胞上PD-1配体过表达。纳武利尤单抗和帕博利珠单抗是针对PD-1的全人源IgG4单克隆抗体,在高剂量化疗(HDT)和ASCT、本妥昔单抗治疗失败的cHL患者中,二者均表现出临床活性。然而,只有少数患者达到完全缓解(CR),大多数患者在18个月内发生疾病进展。
百泽安是一种人源化IgG4单克隆抗体,已被证明以高特异性和亲和力与人PD-1的胞外结构域结合,阻断PD-L1和PD-L2的结合。百泽安经过Fc段独特改造,去除了自身与巨噬细胞表面FcγR结合的能力,避免了抗体依赖的细胞介导的吞噬作用(ADCC),从而更好地发挥T细胞的缓肿瘤作用。
研究方法
该研究是一项在国内开展的单臂、多中心、Ⅱ期、开放的临床研究,旨在评估替雷利珠单抗用于治疗r/r cHL的疗效和安全性。研究纳入70例ASCT后未达到缓解或出现疾病进展、或既往经过≥2线系统化疗且不适合ASCT的r/r cHL患者,接受百泽安200mg IV Q3W的方案,直至出现疾病进展、不可耐受的毒性反应或研究结束。
主要终点为独立审核委员会评估的总缓解率(ORR)(Lugano 2014标准),次要终点包括缓解持续时间(DOR)、至缓解时间、无进展生存期(PFS)、安全性。
研究结果
纳入研究的70例患者至少接受1剂替雷利珠单抗治疗。中位治疗时间为13个月(范围:2-22个月),中位相对治疗强度为100%(范围:62%-101%)。所有患者的安全性和有效性均可评估。60例(85.7%)患者为晚期。13例(18.6%)患者既往接受过ASCT;57例(81.4%)患者不适合进行ASCT,其中53例(93%的不适合ASCT患者)因化疗耐药而不适合进行ASCT。4例患者之前接受过本妥昔单抗治疗。
l 更高缓解率,更深缓解度
完全缓解(CR)对患者意义重大,患者有望获得更久的DOR和PFS,可能为患者带来更好的长期预后和生存获益。该研究中位随访9.8个月结果显示,61例(87.1%)患者达ORR,其中44例(62.9%)患者达到CR;61例缓解的患者自首次缓解后中位随访6.7个月,中位DOR尚未达到。
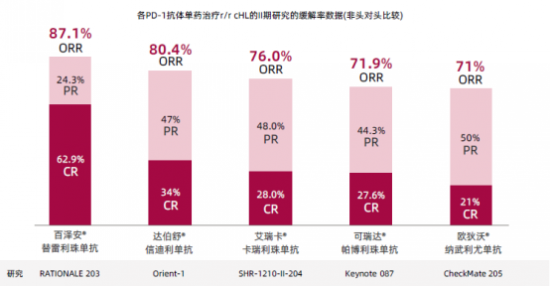
目前治疗r/r cHL的PD-1/PD-L1遏制剂种类繁多,与其他药物相比,PD-1遏制剂百泽安好在哪里呢?下图是各PD-1遏制剂单药治疗r/r cHL的Ⅱ期研究的缓解率数据图(非头对头比较),可以看出,百泽安的ORR**,尤其是CR率显著高于其他药物,可给患者带来更高获益。
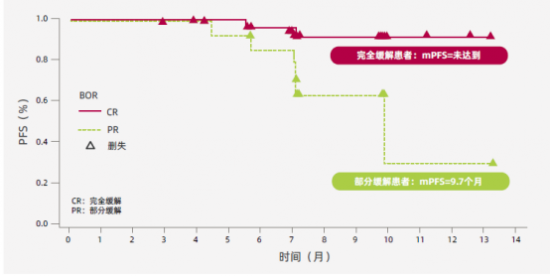
l CR与潜在更好的长期生存相关
研究显示,中位随访9.8个月,中位PFS未达到,9个月PFS为74.5%,达到CR的患者比达到部分缓解(PR)的患者有望获得更多生存获益。
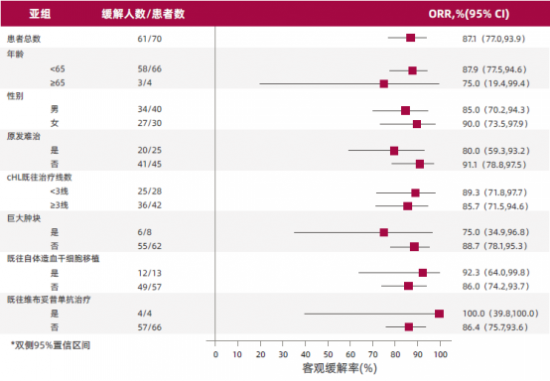
l 不同类型患者均可获益
研究显示,原发难治、经多线治疗及既往接受本妥昔单抗/移植治疗的患者亦能从百泽安治疗中显著获益。
l 安全性良好,不良反应多为一、二级
研究显示,免疫相关的不良反应发生率为38.6%,主要为甲状腺功能异常、皮肤不良反应等。在百泽安治疗期间,无患者发生严重超敏/过敏反应,未发生因不良事件而导致的死亡。
PD-1遏制剂百泽安涵盖适应证范围广
除去r/r cHL这个适应证,2020年4月,基于RATIONALE 204研究结果,NMPA还批准了PD-1遏制剂百泽安用于PD-L1高表达的含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌(UC)的治疗。这是国内**获批尿路上皮癌适应证的PD-1遏制剂,自此,尿路上皮癌患者开启了免疫治疗之路。
此外,NMPA已受理百泽安用于一线治疗晚期鳞状和非鳞状非小细胞肺癌以及既往接受过治疗的不可切除肝细胞癌3个新适应证的上市申请。同时,百泽安正在开展涵盖肺癌、食管鳞癌、肝癌、胃癌及高位卫星不稳定(MSI-H)或错配修复缺陷性(dMMR)实体瘤在内的16项潜在注册性临床试验。其中,针对肺癌的RATIONALE 307、304研究,针对胃癌的RATIONALE 001、102、205、305研究以及针对鼻咽癌的RATIONALE 102研究,都显示出百泽安的良好获益。
小结
RATIONALE203研究向我们展现了PD-1遏制剂百泽安对于r/r cHL患者的显著疗效,尤其是CR率让其他PD-1遏制剂望尘莫及。PD-1遏制剂百泽安的问世,给国内肿瘤患者带来了新的曙光。肿瘤的治疗效果及费用是肿瘤患者及家属的心头患,但百泽安以其卓越的疗效、惠民的政策,使得更多患者有机会用上这个药。未来,我们希望百泽安有更多适应证获批,进一步提高药物可及性,把国内本土创新药物推向全世界!
- 相关标签
新闻回顾 本周 上周
- 让医生的“眼睛”更明亮,海信发布2020-10-20
- 天水玛莉亚医院专业安全人流医院 2020-10-20
- 肺癌和结直肠癌筛查多中心随机对照2020-10-20
- 让诸多企业望而却步的超声产业,海2020-10-20
- 滔滔顾问:单身爸爸前往俄罗斯试管2020-10-20
- 滔滔顾问:想去俄罗斯做试管婴儿,2020-10-20
- 沈阳国防医院看肝病水平好不好 专2020-10-20
- 第83届CMEF开幕 三诺携iPOCT新品共2020-10-20
- 德宝健康医疗:乌克兰特需特需试管2020-10-20
- 滔滔顾问俄罗斯试管婴儿上海答疑会2020-10-20







